Le fleuve, le barrage et les poissons
|La phase de stabilisation : 1997-2002
Texto completo
1Fin 1995, la retenue est remplie, la production d’électricité devient totalement opérationnelle. À l’aval, le seuil de ré-oxygénation fonctionne et la qualité de l’eau est satisfaisante. Dans la retenue, tous les arbres noyés sont morts et, progressivement, les branches tombent en commençant par les plus petites, si bien qu’à la fin de la période, seuls les squelettes des arbres persistent. Les seules touches de vert dans ce paysage hivernal sont les épiphytes (orchidées, broméliacées) qui restent accrochées dans les ramures.
2La question posée alors était le suivi du devenir à long terme de cet écosystème nouveau. Il était impensable de continuer des échantillons mensuels très exigeants en main-d’œuvre et budget. Ainsi une analyse détaillée a été pratiquée pour déterminer les périodes les plus informatives pour les échantillonnages. Deux périodes ont été sélectionnées : le début de la crue et la fin de la décrue. Un des avantages résidait dans le fait que les conditions hydrologiques (débit et hauteur d’eau) sont similaires dans ces deux périodes et peu variables d’une année sur l’autre. Dans ces conditions, l’efficacité des filets maillants est similaire et les échantillons peuvent être comparés. Afin d’obtenir une image complète du système, trois zones ont été sélectionnées dans le cours aval, deux dans la retenue, une au niveau de l’interface entre retenue et amont, et trois zones à l’amont du réservoir. La procédure d’échantillonnage était identique dans chacune des zones. Deux batteries de filets maillants de maille croissante entre 10 et 70 mm de vide de maille étaient posées en fin de journée et relevées le matin suivant.
La variabilité naturelle du climat et de l’hydrologie, ses conséquences sur les paramètres physico-chimiques des milieux
- 1 El Niño est un phénomène climatique à l’échelle de la planète provoqué par un déplacement des mass (...)
- 2 Désigne la différence de niveau entre cotes maximale et minimale.
3La présence du barrage ajoute une source de variabilité à la variabilité naturelle de l’alternance crue-étiage. Le débit à l’aval du barrage ainsi que le niveau de la retenue sont déterminés par trois facteurs principaux : le volume d’eau qui entre dans le lac, les opérations de l’usine hydroélectrique et, dans une moindre mesure, le taux d’évaporation dans la retenue. Parmi ces facteurs, le débit entrant dans le système est prépondérant (fig. 33). On observe, en effet, que les années d’hydraulicité élevée, la crue à l’aval de l’ouvrage peut être maintenue de manière proche des conditions naturelles en dépit des perturbations créées par la production d’électricité. En revanche, pendant les phases El Niño1 la pluviométrie est très déficitaire en Guyane, comme l’est le débit des fleuves. Les entrées d’eau dans la retenue ne sont plus suffisantes pour maintenir un niveau compatible avec le turbinage, d’autant moins que l’ensoleillement important provoque une évaporation élevée. En conséquence, la crue à l’aval est totalement supprimée. Cette variabilité hydrologique a, bien évidemment, des conséquences drastiques sur les milieux aquatiques. Dans la retenue, l’épaisseur de la couche oxygénée (l’épilimnion) varie en fonction du débit entrant dans le réservoir. D’environ 4 m pendant les périodes sèches, elle peut atteindre 7 m lors de crues importantes. Il faut noter cependant que ces variations se font autour d’une moyenne de près de 5 m, constante depuis 1997. Tous les ans, un marnage2 de 4 m expose une surface de 122 km2 qui représente près de 40 % de la superficie totale de la retenue à la cote maximale.
4A l’aval, le seuil de ré-oxygénation a permis d’assurer une bonne qualité chimique de l’eau pendant toute la période d’observation. Le taux d’oxygène dissous est au moins supérieur à 4 mg/l jusqu’à la limite d’influence de l’onde de marée et la concentration en éléments toxiques, comme le méthane, reste inférieure à 1 mg/1. La principale perturbation est donc la modification du régime de crue, particulièrement lors d’années hydrologiques déficitaires. Les conséquences d’une absence de crue sont multiples. Les milieux terrestres marginaux ne sont pas inondés et il n’y a donc pas d’enrichissement du cours d’eau par la litière accumulée, l’apport de nutriments par l’amont est réduit, la vitesse du courant dans les affluents, nourris des pluies locales, est élevée.

Fig. 33
Évolution des débits entrant dans, et sortant de, la retenue de Petit-Saut et de la hauteur d'eau dans le réservoir.
En grisé, les valeurs journalières ; en gras, les moyennes mensuelles (données EDF).
Les peuplements de poissons de l’aval
Les conséquences sur l'abondance des poissons
5Pour mettre en évidence des changements à long terme dans l’abondance des poissons à l’aval, une comparaison est faite entre les prélèvements avant barrage et un nombre équivalent des derniers prélèvements effectués en fin de période. Il y a 14 prélèvements avant barrage, couvrant la période décembre 1991 à décembre 1993, et les 14 derniers échantillons ont été prélevés entre décembre 1999 et janvier 2003, soit entre 6 et 10 ans après la fermeture du barrage (fig. 34). À l’examen des résultats on constate qu’il existe une tendance à une capture plus faible dans la période après barrage. Cependant, la variabilité des captures est telle que cette apparente différence n’est pas statistiquement significative. Dans la période avant barrage, un échantillon comprenait 517 poissons alors que la moyenne des autres est 5 fois plus faible. Dans cet échantillon, une seule espèce (Anchovia surinamensis) comptait pour plus de 300 individus. Ces captures accidentelles sont probablement dues à des épisodes reproductifs exceptionnels et à des déplacements massifs de poissons.

Fig. 34
Comparaison de la capture en nombre et en poids avant et six à dix ans après la fermeture du barrage de Petit-Saut.
Les conséquences sur la diversité
6Les nombres d’espèces cumulés sur les échantillons avant barrage et sur un nombre équivalent des derniers échantillons récoltés sont ajustés à une courbe logistique (fig. 35). On vérifie que la richesse spécifique estimée par cette méthode est très inférieure au cours de la dernière période de collecte (Méronaet al., 2005). Les estimations qui apparaissent dans le tableau 11I font état d’un déficit de l’ordre de 10 espèces. Si l’on compare ces chiffres avec ceux obtenus dans les échantillons de la période qui a suivi la fermeture du barrage, on constate qu’il n’y a pas eu de récupération de la richesse spécifique. Les espèces « perdues » au moment de la mise en eau l’ont apparemment été définitivement.
7Dans le détail, parmi les espèces qui ont disparu des captures en fin de période, seulement 3 étaient communes et abondantes avant barrage (tabl. 12). Cette observation, mais aussi le fait que 2 espèces nouvelles apparaissent dans les captures après barrage, rend discutable la réalité de la disparition totale de 10 espèces. En effet, l’absence d’une espèce rare dans les captures de filets maillants peut être due à une diminution de son abondance et non à l’extinction de sa population. Il n’en reste pas moins qu’il existe une différence statistiquement significative des peuplements entre les phases pré- et post-barrage.
Tableau 11. Résultats des estimations de richesses spécifique par ajustement à un modèle logistique.
|
Nombre d'échantillons |
R2 corrigé |
Richesse théorique |
Intervalle à 95 % |
|
|
Avant barrage |
14 |
0,983 |
42,6 |
41,2- 44,1 |
|
Déc. 99 à janv. 2003 |
14 |
0,987 |
34,6 |
33,7- 35,5 |
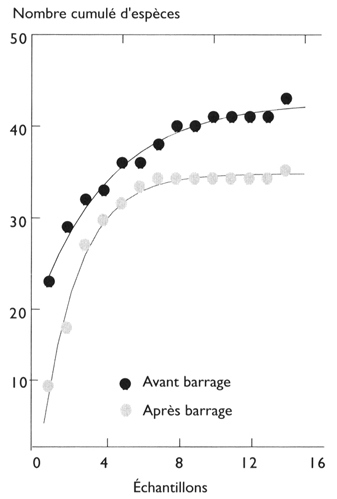
Fig. 35
Ajustements des nombres d'espèces cumulés sur les échantillons de l’aval avant barrage et six à dix ans après.
8Les espèces qui contribuent le plus à cette dissemblance sont, pour celles dont l’abondance diminue : Auchenipterus nuchalis, Pterengraulis atherinoides (une des espèces absentes des captures en phase post-barrage), Triportheus rotundatus, Parauchenipterus galeatus et Leporinus friderici, et, pour celles dont l’abondance relative augmente : Bryconops caudomaculatus, Curimata cyprinoides, Satanoperca jurupari et Cyphocharax spilurus.
Tableau 12. Captures spécifiques en nombre de spécimens à l'aval du barrage de Petit-Saut.
|
Ordre |
Espèce |
Capture |
Capture |
|
Characiformes |
|||
|
Acestrorhynchus falcatus (Bloch, 1794) |
28 |
35 |
|
|
Acestrorhynchus guianensis (Menezes. 1969) |
1 |
24 |
|
|
Astyanax bimaculotus (Linné. 1758) |
6 |
2 |
|
|
Bryconops affinis (Günther. 1864) |
3 |
0 |
|
|
Bryconops caudomaculatus (Günther, 1869) |
140 |
244 |
|
|
Charax pauciradiatus (Günther, 1864) |
31 |
15 |
|
|
Curimata cyprinoides (Linné, 1758) |
84 |
280 |
|
|
Cyphocharax spilurus (Günther, 1864) |
15 |
57 |
|
|
Hemiodopsis quadrimaculatus (Pellegrin, 1908) |
13 |
0 |
|
|
Hemiodus unimaculatus (Bloch, 1794) |
4 |
0 |
|
|
Hoplias aimara (Valenciennes, 1840) |
7 |
4 |
|
|
Hoplios malabaricus (Bloch, 1794) |
1 |
13 |
|
|
Jubiaba keithi (Géry, Planquette & Le Bail, 1996) |
17 |
2 |
|
|
Jubiaba meunieri (Géry, Planquette & Le Bail, 1996) |
1 |
4 |
|
|
Leporinus fasciotus (Bloch. 1794) |
10 |
3 |
|
|
Leporinus fridcrici (Bloch, 1794) |
62 |
22 |
|
|
Leporinus gronti (Eigenmann. 1912) |
3 |
2 |
|
|
Moenkhausia chrysargyrea (Günther. 1864) |
6 |
9 |
|
|
Moenkhausia surinamensis (Géry, 1965) |
1 |
6 |
|
|
Myleus rhomboidalis (Cuvier. 1818) |
5 |
0 |
|
|
Myleus temetzi (Norman, 1929) |
28 |
4 |
|
|
Piabucus dentatus (Koelreuter, 1761) |
10 |
13 |
|
|
Poptella brevispina (Reis, 1989) |
46 |
43 |
|
|
Triportheus rotundatus (Schomburk, 1841) |
243 |
64 |
|
|
Silurtformes |
|||
|
Auchenipterus nuchalis (Spix, 1829) |
314 |
234 |
|
|
Doras carinatus (Linné. 1766) |
6 |
21 |
|
|
Hypostomus gymnorhynchus (Norman, 1926) |
3 |
0 |
|
|
Loricaria cataphracta (Linné. 1758) |
4 |
29 |
|
|
Parauchenipterus galeatus (Linné. 1766) |
77 |
3 |
|
|
Pimelodella cristata (Müller & Troschel, 1848) |
2 |
3 |
|
|
Pimelodella geryi (Hoedeman, 1961) |
3 |
0 |
|
|
Pseudauchenipterus nodosus (Bloch. 1794) |
7 |
8 |
|
|
Tatia intermedia (Steindachner. 1876) |
17 |
0 |
|
|
Gymnotiformes |
|||
|
Eigenmania virescens (Valenciennes, 1847) |
6 |
8 |
|
|
Sternopygus macrurus (Bloch & Schneider. 1801) |
1 |
2 |
|
|
Perciformes |
|||
|
Centropomus parallelus (Bey, 1860) |
16 |
2 |
|
|
Geophogus surinamensis (Bloch, 1791) |
1 |
19 |
|
|
Plagioscion squamosissimus (Heckel, 1840) |
2 |
4 |
|
|
Salanoperca jurupari (Heckel, 1840) |
0 |
85 |
|
|
Clupeiformes |
|||
|
Anchovia surinamensis (Bleeker, 1866) |
320 |
69 |
|
|
Anchoviella lepidentostole (Fowler. 1911) |
13 |
0 |
|
|
Lycengraulis batesii (Günther. 1868) |
6 |
0 |
|
|
Pellona flavipinnis (Valenciennes, 1847) |
12 |
2 |
|
|
Pterengraulis atherinoides (Linné, 1766) |
198 |
0 |
|
|
Elopiformes |
|||
|
Tarpon atlanticus (Cuvier & Valenciennes. 1846) |
0 |
15 |
|
|
Nombre total d’espèces |
42 |
35 |
9Une analyse de similarité (ANOSIM ; Clarke et Gorley, 2001) montre que la structure trophique des peuplements est statistiquement différente entre les prélèvements de la phase pré-barrage et ceux réalisés en fin de période (Méronaet al., 2005). L’abondance de la guilde des herbivores ainsi que celle des guildes des omnivores et invertivores s’alimentant à partir de matériel terrestre sont celles qui diminuent le plus, tandis que l’abondance des détritivores augmente. De fait, la plupart des espèces dont l’abondance diminue s’alimentent à partir des ressources d’origine terrestre, feuilles, fruits ou insectes terrestres, alors que les espèces favorisées sont des détritivores ou des petits carnassiers. Il est clair que l’absence ou la réduction de la crue limite l’accès aux milieux marginaux qui procurent au milieu aquatique les ressources alimentaires exogènes. En revanche, l’enrichissement de l’eau en nutriments, provenant de la décomposition végétale dans le réservoir, est favorable au développement des algues consommées par les détritivores. Les petits carnivores, quant à eux, profitent vraisemblablement de la plus grande vulnérabilité des juvéniles qui ne disposent plus de la protection des zones inondées.
10Les stratégies de reproduction développées par les espèces pourraient aussi expliquer les changements dans leur abondance. On a vu que les caractéristiques de l’habitat modulent les stratégies reproductrices des poissons dans une communauté (voir chapitre 3). Le bouleversement du rythme naturel des crues à l’aval du barrage peut ainsi être préjudiciable aux espèces qui se reproduisent au moment de la montée des eaux (Ponton, 2001). Il semble bien, en effet, que la disparition de Pterengraulis atherinoides des captures soit liée à son mode de reproduction, qui consiste à produire un grand nombre de petits œufs, dispersés dans le milieu. L’augmentation du nombre de Cichlidae tels Satanoperca jurupari et Geophagus surinamensis pourrait également être attribuée à leur stratégie reproductrice. Ces deux dernières espèces produisent un petit nombre de gros œufs et développent certains comportements de soins parentaux, ce qui les affranchit des perturbations du milieu. Au niveau de la communauté, l’analyse de similarité ne permet cependant pas de détecter statistiquement ces tendances dans l’évolution des stratégies de reproduction. Il est probable que le temps nécessaire à la manifestation de ces changements soit beaucoup plus long que la période d’une dizaine d’années analysée jusqu’à présent.
Conclusion sur l'aval
11Le barrage de Petit-Saut a donc profondément altéré la diversité et la composition de la communauté de poissons à l’aval. Sa présence a accentué la variabilité climatique naturelle. Les modifications ont principalement porté sur l’organisation trophique des peuplements par le biais de la disponibilité des ressources alimentaires disponibles pour les poissons. On ne peut exclure cependant que, pour certaines espèces, les stratégies de reproduction jouent un rôle dans leur développement dans la zone aval. Beaucoup d’études portant sur les effets des barrages sur les peuplements de poissons évoquent la suppression des processus migratoires comme un impact majeur (Brooker, 1981 ; Petts, 1984). La plupart du temps, ces études portent sur des bassins où il existe de grands migrateurs tels que le Saumon, dont les populations sont profondément affectées par la présence des barrages. Dans le Sinnamary, aucun mouvement migratoire de masse de poissons n’a été observé, en dépit d’une présence fréquente sur le site. On ne peut cependant exclure qu’il existait des déplacements individuels de poissons entre l’aval et l’amont, dans un sens comme dans l'autre, et que le blocage de ces déplacements ait eu une influence sur les peuplements aval.
Les peuplements de poissons de la retenue et de l’amont
Évolution de l'abondance
12Entre 1996 et 2002, on a assisté à une décroissance continue de la capture des poissons dans la retenue, tant en nombre d’individus qu’en terme de poids (Mérona, 2002) (fig. 36). Bien sûr, comme il a déjà été signalé, la capture aux filets maillants n’est pas strictement un indice d’abondance ; elle est proportionnelle à la densité des poissons dans le milieu et elle est donc dépendante du volume.

Fig. 36
Évolution de la capture en nombre de poissons et en poids dans la retenue de Petit-Saut entre 1996 et 2002.
Les lignes en traits fins correspondent à des ajustements polynomiaux d’ordre 2.
13Cependant, compte tenu du fait que, au cours de la période considérée, le volume disponible pour les poissons s’est maintenu grossièrement constant, il est possible d’interpréter cette diminution de capture comme un déclin de l’abondance. Ce déclin, qui fait suite à la très forte augmentation observée dans les deux premières années de la mise en eau, est un phénomène bien connu de l’évolution des retenues. L’important apport de nutriments provenant de la décomposition de la végétation et de la litière inondée pendant l’inondation se tarit progressivement, une grande partie des matières en suspension se dépose au fond du lac, inaccessible aux poissons à cause de la désoxygénation. D’une manière générale, la capture (et donc l’abondance) semble se stabiliser à un niveau qui se rapproche de celui observé dans le fleuve à l’amont. Une autre observation peut être faite à l’examen de la figure 36 : il s’agit de la relation entre le nombre de poissons capturés et le poids total de cette capture. Dans le fleuve, les deux courbes se superposent aux échelles considérées, alors que dans le lac, la courbe du nombre est le plus souvent largement au-dessus de la courbe des poids. La conclusion est, qu’en moyenne, les poissons sont de plus petite taille dans le réservoir que dans la rivière.
Tableau 13. Comparaison des captures en nombre dans les différents secteurs de la retenue de Petit-Saut. Probabilités pour que deux valeurs soient égales. Une probabilité faible correspond à une différence significative entre les deux valeurs. Les astérisques indiquent des différences significatives.
|
Zone basse |
Zone centrale |
|
|
Zone centrale |
P < 0,0l4* |
|
|
Tête |
P = 0,007** |
P = 0,424 |
14Comme le montrent la figure 37 et le tableau 13, les poissons ne sont pas répartis uniformément le long de l’extension de la retenue. Ils sont significativement plus abondants dans les parties moyenne et haute de la retenue que dans sa partie basse. Cependant, ces différences ont tendance à s’atténuer avec le temps. Pour expliquer cette évolution, on peut imaginer que, dans les premières années, les poissons ont eu tendance à fuir la partie basse dont le milieu s’est dégradé plus tôt, en recherchant plus à l’amont des milieux plus propices à la vie. Avec l’homogénéisation du milieu, la répartition deviendrait plus homogène. On note par ailleurs une variabilité beaucoup plus importante dans la zone de connexion avec le fleuve. Deux facteurs peuvent être à l’origine de cette variabilité importante. D’une part, il y a le fait qu’il s'agit d’un milieu extrêmement variable en fonction du niveau du lac, parfois ressemblant à la rivière avec un courant violent lorsque le niveau du lac est bas, parfois constitué d’eau stagnante quand le lac est rempli. D’autre part, le contact entre la retenue et le fleuve amont est une cascade au dénivelé important qui constitue un obstacle aux déplacements des poissons. Le fait qu’on observe les captures les plus élevées en juin, au moment de la crue, laisse penser qu’il peut exister à cette époque des déplacements vers l’amont de nombreuses populations de poissons qui s’accumuleraient au pied du saut. Dans toutes les zones, les biomasses capturées suivent grossièrement la même évolution que les captures en nombre, ce qui montre une stabilité dans le poids moyen des poissons, tant dans le temps que dans l’espace.
15Deux milieux contrastés ont été échantillonnés. Les eaux libres correspondent à la localisation de l’ancien lit du fleuve. Elles ne présentent aucune végétation résiduelle et la profondeur y est élevée. Pour prospecter les marges, les filets sont placés le plus loin possible de l’ancien lit, dans des milieux peu profonds et où la circulation d’eau est très faible. En dépit de ces différences dans les caractéristiques des milieux, aucune différence dans l’abondance en poissons n’est relevée (fig. 38).
La diversité des peuplements : la notion de filtre environnemental
16Un schéma conceptuel a récemment été développé pour expliquer la répartition des espèces de poissons dans les différents milieux. Il s’agit du concept de filtre environnemental (Tonn, 1990 ; Tonnet al., 1990). Il consiste à imaginer une série de filtres qui sélectionnent les espèces de proche en proche à partir d’un pool d'espèces, pour aboutir à la composition d’une faune locale. Ainsi en Guyane, l’ichtyofaune du Sinnamary est un sous-ensemble de l’ichtyofaune de la région et les communautés que l’on trouve dans les vasques sont elles-mêmes des sous-ensembles de la faune du Sinnamary. Ces filtres sont le résultat de contraintes liées au milieu lui-même qui permet ou interdit la colonisation par certaines espèces. La formation d’une retenue est une transformation rapide de l’habitat aquatique dont les nouvelles caractéristiques vont constituer un filtre pour les espèces présentes dans la rivière. Les études dans les lacs de barrage sont donc une excellente illustration du concept de filtre environnemental.
Richesse spécifique et structure des peuplements
17Comme dans le chapitre précédent, la comparaison des richesses spécifiques dans le fleuve et dans la retenue aux différentes périodes est effectuée en ajustant les nombres d’espèces cumulés sur le nombre d’échantillons à une courbe logistique (fig. 39).
18Après la brusque augmentation du nombre d’espèces obtenu dans les captures pendant et immédiatement après la mise en eau, ce nombre diminue fortement jusqu’en 1999, soit quatre à cinq ans après la fermeture. Dans les années récentes, la richesse spécifique remonte dans le réservoir, ce qui laisse penser qu’un certain nombre d’espèces parviennent à s’adapter à ce nouveau milieu.
19Dans le détail, 9 espèces relativement abondantes ou constantes dans les captures amont ne se retrouvent pas dans le lac (tabl. 14). Ces espèces sont très variées, tant dans leur forme que dans leur comportement et il est impossible sur la base de leur seule position systématique de mettre en évidence un point commun qui pourrait expliquer leur absence dans le lac. Par ailleurs, il s’agit uniquement dans cette analyse de la faune pélagique, celle qui est capturée par les filets maillants. De fait, certaines de ces espèces sont présentes et peuvent même être abondantes dans les zones de bordure du lac, comme l’ont montré des pêches ultérieures au poison. Trois espèces présentes et relativement abondantes dans le réservoir n’ont pas été capturées dans le fleuve à l’amont (tabl. 14). Cette observation est à rapprocher de la distribution longitudinale des espèces dans le bassin. En effet, ces espèces étaient, avant barrage, plutôt inféodées au secteur le plus aval de la rivière, absentes ou rares dans les zones amont. Le barrage étant implanté dans la partie aval a donc piégé quelques espèces qui ont pu coloniser l’ensemble de la retenue.

Fig. 39
Évolution du nombre d'espèces cumulé sur les échantillons successifs dans le fleuve Sinnamary et dans la retenue de Petit-Saut.
Ajustements à un modèle logistique.
Tableau 14. Liste des principales espèces ayant disparu de la faune pélagique du réservoir et de celles présentes dans le réservoir et absentes des captures dans le fleuve pendant la même période.
|
Espèces de l’amont |
Espèces du lac |
||
|
Nom de l’espèce |
Capture |
Nom de l’espèce |
Capture |
|
Cyphocharax helleri |
75 |
Charax pauciradiatus |
457 |
|
Anostomus brevior |
70 |
Plagioscion squamosissimus |
17 |
|
Bivibronchia bimaculata |
29 |
Satanoperca jurupari |
16 |
|
Krobia guianensis |
22 |
||
|
Corydoras spilurus |
13 |
||
|
Crenicichla saxatilis |
10 |
||
|
Hartia surinamensis |
8 |
||
|
Tatia intermedia |
3 |
||
|
Pyrrhulina filamentosa |
3 |
||
|
Pimelodella geryi |
3 |
20Les caractéristiques globales des échantillons (indices de diversité et de régularité des distributions d’abondance des espèces) sont significativement différentes entre l’amont du fleuve et le réservoir (tabl. 15). On constate une importante diminution de la régularité dans la distribution d’abondance des espèces. Dans le réservoir, une ou un petit nombre d’espèces dominent le peuplement. L’indice de diversité, qui représente l’intégration de la richesse spécifique et de la régularité, suit logiquement la même tendance. Ces caractéristiques sont classiquement associées à un certain déséquilibre des peuplements, ce qui suggère que les peuplements du lac n’ont pas encore atteint leur climax, une conclusion corroborée par l’augmentation significative de la régularité dans le lac entre la période 1996-1998 et la période 1999-2000.
Tableau 15. Comparaison de la diversité et de la régularité des échantillons récoltés à l'amont et dans le réservoir. Im indice de diversité de Shannon moyen ; Em équitabilité moyenne ; dans la demi-matrice supérieure, résultat des tests sur les indices de diversité, en bas résultats des tests sur l’équitabilité.

Composition taxonomique des peuplements
21En fournissant une information plus détaillée sur l’évolution des peuplements du réservoir, les changements dans leur composition spécifique renseignent sur la manière dont les assemblages de poissons s’organisent. En effet, l’absence d’une espèce, naturellement rare dans les échantillons, peut avoir moins de sens écologique que la diminution drastique de l’abondance d’une espèce naturellement dominante. Une analyse multivariée permet de visualiser ces changements dans les assemblages (fig. 40).

Fig. 40
Projection des échantillons et des espèces dans le plan 1-2 de l'analyse factorielle des correspondances. Ne sont portées que les espèces qui contribuent le plus à la définition des axes.
22Les deux plus importants facteurs de variabilité des peuplements sont à l’évidence liés à leur répartition spatiale. Les échantillons de la retenue sont bien séparés de ceux du fleuve et les prélèvements réalisés en tête de retenue apparaissent dans une position intermédiaire. Les espèces qui correspondent à cette séparation sont Charax pauciradiatus, Triportheus rotundatus, Parauchenipterus galeatus et Bryconops caudomaculatus pour le réservoir et Chilodus zunevei, Myleus ternetzi, deux espèces de Moenkhausia, deux espèces de Cyphocharax et deux espèces de Bryconops pour le fleuve.
23Quand on classe les prélèvements en fonction de la saison, on observe qu’il existe une certaine évolution saisonnière dans le fleuve et au front, alors que dans le réservoir l’importante variabilité mise en évidence par la dispersion des points ne semble pas liée à la saison de capture (fig. 41).

Fig. 41
Projection par secteur et par saison des échantillons dans le plan 1-2 de l’analyse factorielle des correspondances.
Le rôle des stratégies de vie des poissons
24Afin de tester le rôle des stratégies de vie des poissons dans leur capacité à traverser le filtre environnemental constitué par la transformation du fleuve en lac, nous comparons les structures fonctionnelles des peuplements dans le fleuve et dans le réservoir en phase de stabilisation. Une analyse de similarité (ANOSIM ; Clarke et Gorley, 2001) est utilisée. Il s’agit de calculer les similarités deux à deux entre échantillons provenant de deux groupes, de comparer les similarités moyennes à l’intérieur des groupes et entre groupes, puis d’évaluer la probabilité d’obtenir un résultat similaire en tirant au hasard les échantillons, c'est-à-dire sous l’hypothèse d’une absence de différence entre groupes.
Stratégies nutritionnelles
25Les résultats des analyses sur les stratégies nutritionnelles montrent qu’elles ont un rôle significatif dans la survie des populations de poissons du fleuve dans la retenue (tabl. 16). Les omnivores constituent le groupe qui se développe le mieux dans le réservoir (Méronaet al., 2003). Ce résultat concorde avec les expectations. En effet, les poissons omnivores ont a priori la faculté de capturer et de digérer des aliments d’origine variée. Ils peuvent ainsi s’adapter plus facilement aux changements de ressources alimentaires provoqués par la transformation du milieu. Les détritivores et les invertivores d’invertébrés terrestres présentent aussi une abondance relative plus élevée dans le lac. Au sens utilisé ici, les détritivores consomment la pellicule organique déposée au fond ou sur les substrats. Dans un lac de barrage, le développement de cette ressource est favorisé par deux facteurs. D’une part, la stagnation de l’eau provoque le dépôt des solides en suspension, entraînés par le courant dans la rivière, et, d’autre part, la plus grande transparence de l’eau induit un développement des algues fixées. Quant aux invertivores d’invertébrés terrestres, ils profitent de la retombée de termites provenant des arbres morts, nombreux dans la retenue. À l’inverse, les prédateurs ichtyophages et les végétariens sont moins abondants dans les communautés de la retenue. Il est clair que les végétariens n’ont plus accès à la végétation de bordure qui, dans la rivière, fournit une grande quantité de ressources telles que fruits, fleurs et feuilles qui tombent dans l’eau. La diminution de l’abondance des prédateurs ichtyophages est plus difficile à interpréter. Dans un certain nombre de lacs de barrage, leur abondance au contraire augmente, au moins dans un premier temps (Méronaet al., 2001). Cette augmentation, principalement due à la prolifération d’espèces de piranhas (Serrasalmus spp.) et de Cichlidae (Cichla sp.), a été attribuée à la densité élevée de proies constituées par les juvéniles issus du succès de la reproduction de beaucoup d’espèces lors de la mise en eau. À Petit-Saut, ces deux groupes d’espèces sont absents et il est possible que les prédateurs présents aient des difficultés à se reproduire dans la retenue.
Tableau 16. Résultats de l'analyse de similarité entre le fleuve et la retenue utilisant les structures fonctionnelles basées sur les régimes alimentaires.
|
Fleuve |
Retenue |
|||
|
Régime |
Biomasse |
Biomasse |
Contribution |
Cumul |
|
Omnivore |
15,84 |
37,92 |
29,06 |
29,06 |
|
Végétarien |
36,50 |
16,70 |
23,89 |
52,95 |
|
Ichtyophage |
29,88 |
16,96 |
22,86 |
75,81 |
|
Détritivore |
11,30 |
13,61 |
12,55 |
88,36 |
|
Invert. terr. |
6,47 |
14,81 |
11,64 |
100,00 |
Stratégies de reproduction
26L’analyse de similarité passée sur les structures de peuplements basées sur les stratégies de reproduction montre également que celles-ci ont un rôle significatif sur le développement des populations au sein de la retenue (tabl. 17). Deux groupes reproducteurs voient leur abondance relative diminuer. Celui dont l’abondance diminue le plus est celui d’espèces de petite taille avec de petits œufs et une fécondité relative élevée. Dans le fleuve, ces espèces se reproduisaient assez tardivement dans leur vie, et libéraient en une seule fois un grand nombre d’ovocytes. En revanche, le groupe qui s’adapte le mieux aux conditions de la retenue comprend les espèces de taille moyenne à fécondité relativement faible. En vue de déterminer quels traits particuliers sont impliqués dans le filtrage de ces espèces, les moyennes de chacun des traits dans les échantillons sont calculées et une nouvelle analyse de similarité est pratiquée (tabl. 18). Il apparaît que les deux traits qui contribuent le plus à la dissimilarité entre fleuve et retenue sont la fécondité et la taille maximale. Autrement dit, pour se développer dans le réservoir, les espèces ne doivent pas en même temps être de grande taille et présenter une forte fécondité. L’interprétation de ces observations en termes écologiques est, en l’état actuel des connaissances, difficile à déterminer. On ignore en effet les comportements reproducteurs de ces poissons, dans quel habitat ils pratiquent la reproduction, comment se fait la fécondation des ovocytes ou quels sont les facteurs de milieu qui déterminent la survie des œufs et des alevins.
Tableau 17. Résultats de l'analyse de similarité entre le fleuve et la retenue utilisant les structures fonctionnelles basées sur les stratégies de reproduction.
|
Fleuve |
Retenue |
|||
|
Groupe |
Abondance |
Abondance |
Contribution |
Cumul |
|
Groupe 1 |
28,95 |
52,26 |
39,08 |
39,08 |
|
Groupe 4 |
20,28 |
2.,38 |
29,02 |
68,10 |
|
Groupe 2 |
28,61 |
18,23 |
19,40 |
87,50 |
|
Groupe 3 |
22,17 |
27,13 |
12,50 |
100,00 |
Tableau 18. Résultats de l'analyse de similarité entre le fleuve et la retenue utilisant les structures fonctionnelles basées sur les moyennes des traits.
|
Fleuve |
Retenue |
|||
|
Trait |
Moyenne |
Moyenne |
Contribution |
Cumul |
|
Fécondité relative (nb/g) |
177,86 |
119,52 |
47,22 |
47,22 |
|
Taille maximale (mm) |
212,17 |
210,86 |
35,56 |
82,78 |
|
Ovocytes matures (%) |
78,90 |
76,60 |
7,93 |
90,71 |
|
Taille relative à la maturité (%) |
54,18 |
52,99 |
7,05 |
97,76 |
|
Longueur de la période de reproduction (mois) |
8,83 |
9,71 |
2,14 |
99,90 |
|
Diamètre des ovocytes (mm) |
0,96 |
0,88 |
0,10 |
100,00 |
Tableau 19. Résultats de l'analyse de similarité entre le fleuve et la retenue utilisant les structures fonctionnelles basées sur les moyennes des traits morphologiques (seuls sont portés les traits qui contribuent le plus à la dissemblance).
|
Fleuve |
Retenue |
|||
|
Trait |
Moyenne |
Moyenne |
Contribution |
Cumul |
|
Hauteur/longueur de la tête |
1,00 |
1,02 |
28,03 |
28,03 |
|
Largeur/hauteur du corps |
0,51 |
0,49 |
19,98 |
48,01 |
|
Position de l’œil |
0,59 |
0,61 |
15,87 |
63,88 |
|
Taille de l’œil |
0,53 |
0,52 |
12,11 |
76,00 |
|
Largeur/longueur du corps |
0,15 |
0,14 |
9,21 |
85,21 |
27D’autres caractéristiques des espèces peuvent jouer un rôle dans leur adaptabilité aux conditions de la retenue. On peut penser par exemple que les capacités de nage pourraient influer sur l’adaptation des espèces dans un milieu lacustre où elles n’ont plus à lutter contre le courant. Une analyse portant sur les caractéristiques morphologiques des espèces n’a cependant pas permis de mettre en évidence de différence significative dans l’abondance relative des groupes morphologiques. En revanche, l’analyse basée sur les moyennes de chacun des traits morphologiques dans les échantillons génère le résultat inverse. Ainsi, dans la retenue, sont favorisés les corps aplatis latéralement et des yeux petits placés en position dorsale (tabl. 19). Ces caractères sont ceux d’espèces d’eau calme, peu adaptées à la nage rapide.
Conclusions sur la retenue
28L’ensemble de ces résultats montre bien que la transformation du fleuve Sinnamary en lac de retenue constitue un filtre qui sélectionne les espèces en fonction d’un certain nombre de caractéristiques, et donc conforte l’hypothèse du filtre environnemental pour expliquer la distribution des espèces dans les différents milieux. En effet si, comme il est montré ici, certains traits écologiques ne peuvent s’exprimer dans un habitat donné, il serait possible de prévoir dans une certaine mesure quel type d’espèces on peut s’attendre à trouver dans un milieu déterminé. Dans le cas d’un lac de barrage, une anticipation de cette nature peut aider à prendre des mesures visant à une éventuelle exploitation des ressources piscicoles de la retenue.
Notas
1 El Niño est un phénomène climatique à l’échelle de la planète provoqué par un déplacement des masses d’eau chaudes superficielles du Pacifique de l’ouest vers l’est.
2 Désigne la différence de niveau entre cotes maximale et minimale.
Índice de ilustraciones
 | |
|---|---|
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-1.jpg |
| Archivo | image/jpeg, 95k |
 | |
| Leyenda | Fig. 33Évolution des débits entrant dans, et sortant de, la retenue de Petit-Saut et de la hauteur d'eau dans le réservoir.En grisé, les valeurs journalières ; en gras, les moyennes mensuelles (données EDF). |
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-2.jpg |
| Archivo | image/jpeg, 155k |
 | |
| Leyenda | Fig. 34Comparaison de la capture en nombre et en poids avant et six à dix ans après la fermeture du barrage de Petit-Saut. |
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-3.jpg |
| Archivo | image/jpeg, 48k |
 | |
| Leyenda | Fig. 35Ajustements des nombres d'espèces cumulés sur les échantillons de l’aval avant barrage et six à dix ans après. |
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-4.jpg |
| Archivo | image/jpeg, 43k |
 | |
| Leyenda | Fig. 36Évolution de la capture en nombre de poissons et en poids dans la retenue de Petit-Saut entre 1996 et 2002.Les lignes en traits fins correspondent à des ajustements polynomiaux d’ordre 2. |
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-5.jpg |
| Archivo | image/jpeg, 111k |
 | |
| Leyenda | Fig. 37Évolution de la capture en nombre dans trois zones de la retenue de Petit-Saut. |
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-6.jpg |
| Archivo | image/jpeg, 91k |
 | |
| Leyenda | Fig. 38Évolution de la capture en nombre dans deux milieux différents de la retenue de Petit-Saut. |
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-7.jpg |
| Archivo | image/jpeg, 87k |
 | |
| Leyenda | Fig. 39Évolution du nombre d'espèces cumulé sur les échantillons successifs dans le fleuve Sinnamary et dans la retenue de Petit-Saut.Ajustements à un modèle logistique. |
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-8.jpg |
| Archivo | image/jpeg, 60k |
 | |
| Título | Tableau 15. Comparaison de la diversité et de la régularité des échantillons récoltés à l'amont et dans le réservoir. Im indice de diversité de Shannon moyen ; Em équitabilité moyenne ; dans la demi-matrice supérieure, résultat des tests sur les indices de diversité, en bas résultats des tests sur l’équitabilité. |
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-9.jpg |
| Archivo | image/jpeg, 103k |
 | |
| Leyenda | Fig. 40Projection des échantillons et des espèces dans le plan 1-2 de l'analyse factorielle des correspondances. Ne sont portées que les espèces qui contribuent le plus à la définition des axes. |
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-10.jpg |
| Archivo | image/jpeg, 115k |
 | |
| Leyenda | Fig. 41Projection par secteur et par saison des échantillons dans le plan 1-2 de l’analyse factorielle des correspondances. |
| URL | http://books.openedition.org/irdeditions/docannexe/image/22790/img-11.jpg |
| Archivo | image/jpeg, 44k |
Salvo indicación contraria, el texto y otros elementos (ilustraciones, archivos adicionales importados) se puede utilizar bajo licencia OpenEdition Books License.






